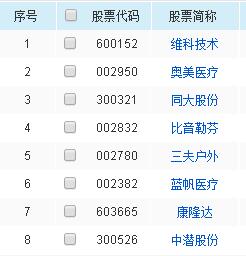
先声药业(HK02096,股价13.40港元,市值356.49亿港元)公告称,公司与中国科学院上海药物研究所、武汉病毒研究所联合开发的创新药先诺欣(先诺特韦片/利托那韦片组合包装)新药上市申请(NDA)获国家药品监督管理局(NMPA)以药品特别审批程序受理,拟用于治疗轻至中度新型冠状病毒感染(COVID-19)成年患者。
何为药品特别审批程序?据记者了解,药监局于2005年发布了《药品特别审批程序》,为突发公共卫生事件应急所需防治药品尽快获得批准提供了制度上的保障。2020年新修订的《药品注册管理办法》第四节第七十二条则同样提到,“在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,国家药品监督管理局可以依法决定对突发公共卫生事件应急所需防治药品实行特别审批。”
实际上,目前国内批准的三款新冠小分子口服药(辉瑞的Paxlovid、真实生物的阿兹夫定、默沙东的Molnupiravir)都是按照药品特别审批程序,进行应急审评审批,附条件批准上市的。此外,这三款药物也都在附条件批准时被注明:“国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。”
值得注意的是,无论是特别审批还是附条件上市等各种加速药品审批的手段,都不是单向和不可逆的。加速审批的药物在后续使用过程中,一旦出现安全性和真实世界的疗效问题,都可以启动召回程序;监管机构对此类审批的药物上市后再评价工作,都是同步进行的,这也写在《特别审批程序》和《药品注册管理办法》中。
安信证券在研报中称,国内有望于2023年第一季度迎来多个国产新冠口服小分子药物关键临床数据披露,有望于2023年上半年迎来多个药物获批上市。
先声药业在回复《每日经济新闻》记者询问时进一步介绍,目前,公司已经为先诺欣的生产做了充分准备。产能方面,准备了原料药厂以及集团旗下制药基地,作为一旦获批后的生产场所。公司也将根据疫情态势的变化和临床需求,随时动态调整产能。

图片来源:公司官网
而在先诺欣的定价上,尽管目前还未最终确定,但先声药业董事长任晋生曾在2022年中期业绩发布会上回答投资人的提问时称:“结合我们的成本优势以及中国的国情,我们的定价应该会比P药(即辉瑞的Paxlovid)大幅度降低,这样才能覆盖更多的病人。”
II/III期临床研究正处于数据读出和分析阶段
2021年11月17日,先声药业与中国科学院上海药物研究所、武汉病毒研究所订立技术转让合同,获得先诺特韦在全球开发、生产及商业化的独家权利。2022年3月28日及5月13日,先诺欣分别获国家药品监督管理局签发的2项药物临床试验批准通知书。
2022年8月19日,一项评估先诺欣治疗轻中度COVID-19成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的Ⅱ/Ⅲ期临床研究达成首例患者入组;2022年12月16日完成全部1208例患者入组,成为国内3CL靶点口服小分子药物首个II/III期临床研究完成入组的项目。
先声药业方面介绍,先诺欣注册临床研究由中国医学科学院、国家呼吸医学中心王辰院士,中日友好医院教授曹彬牵头,复旦大学附属中山医院樊嘉院士、复旦大学附属中山医院感染病科主任胡必杰教授共同指导完成,是第一个针对中国人群感染奥密克戎毒株的大样本临床试验,也是国内外第一个针对奥密克戎毒株感染者达成“以咳嗽、鼻塞流涕、咽痛、发热、头痛、肌肉或全身痛等11个症状持续恢复”为主要终点的III期注册临床研究。
关于临床研究进展,先声药业方面回复《每日经济新闻》记者称:“目前先诺欣的II/III期临床研究正处于数据读出和分析阶段。”
纵观目前国内外各类新冠口服药,两大主流靶点分别是3CLpro和RdRp。其中,包括先声药业的SIM0417在内,辉瑞的Paxlovid、日本盐野义的S-217622、众生药业的RAY1216等药物作用靶点均为3CLpro,而默沙东的Molnupiravir、君实生物(SH688180,股价63元,市值619.21亿元)在研的VV116、真实生物的阿兹夫定等药物作用靶点均为RdRp。
先声药业方面表示,之所以选择开发3CL口服小分子新冠药物,是基于从作用机理、剂型是否具备更广泛的运输和使用条件(结合中国国情,面积大、人口多、医疗基础条件差异性较大)等因素综合考虑的结果。从已公告情况看,先声药业是国内3CL这一靶点中研发进度最快的一家。